العلاج بالخلايا الجذعية لإصابات وتر الخيول
إصابات SDFT في الخيول والطب التجديدي
تعد إصابات وتر العضلة العريضة الرقمية (SDFT) أصلًا مهمًا للعرج والرياضي المتناقص في الصناعة الرياضية للخيول ، مع انتشار موصوف من 8 إلى 43٪ في سباق الخيول الأصيلة (Dowling ، 2000). ويرجع ذلك إلى ارتفاع معدل انتشار هذه الإصابات ومدة الاستشفاء الممتدة وارتفاع معدل التكرار. إصابات SDFT هي بطء في الشفاء ، مع 20-60 ٪ من خيول السباق المصابة تعود إلى القدرة الرياضية الكاملة ، ولكن مع ما يصل إلى 80 ٪ من السباق المصاب يستسلم لإعادة الإصابة (Dowling ، 2000). هذا الميل للشفاء ببطء ، وبناء مصفوفة خارج الخلية أقل ميكانيكيا ، من المحتمل أن يرجع ذلك إلى حقيقة أن الأوتار يتم توعيتها بالحد الأدنى ، وخلايا موجودة بتقليل النشاط الانقسامي ، ولديها عدد قليل من الخلايا السلفية الموجودة في الأنسجة. وقد أوضحت التحقيقات الحديثة في الخلايا الجذعية الوسيطة (MSCs) التطور المحتمل لاستخدام الطب التجديدي كعلاج جديد محتمل لإصابات SDFT.
تعد إصابات وتر العضلة العريضة الرقمية (SDFT) أصلًا مهمًا من العرج والرياضي المتناقص في صناعة الألعاب الرياضية للخيول ، مع انتشار موصوف بنسبة 8 إلى 43٪ في سباق الخيول الأصيلة.
هيكل وتر في حصان
تتكون الأوتار في الغالب من الماء (حوالي 70 ٪) ؛ 30 ٪ المتبقية تحتوي على الكولاجين ومصفوفة خالية من الكولاجين. ضمن الأوتار المثنية العادية ، النوع الأول هو الكولاجين الأكثر شيوعًا. الأنواع II و III و IV و V موجودة أيضًا ، على الرغم من وجود كميات أقل في المواضع الأكثر تحديدًا داخل الوتر. يمكن وضع النوع الثاني في عمليات الإدراج العظمية والمناطق التي يغير فيها الاتجاهات اتجاهات لتغطية الإسقاط العظمي ، وهو مصمم لتحمل الضغط والتوتر. توجد الأنواع الثالثة والرابعة والخامسة فقط في أغشية القبو والإندوتندون. يتم تنظيم جزيئات الكولاجين في ألياف دقيقة ، ألياف فرعية ، وألياف ليفية ، ويتم تصنيفها أيضًا في كراسات مقسّمة بشكل فضفاض عن طريق septa endotenon ، وتتكون المصفوفة المتبقية من الكريات البيضاء والبروتينات السكرية. تم التعرف على أنواع الخلايا I و II و III داخل كراسات وتر الخيول. يختلف تخصيص هذه الخلايا مع تقدم العمر ، وقد يرتبط في الغالب بتوليف المصفوفة خارج الخلية. تم العثور على العديد من الجليكوزامينوغليكان في SDFTs العادية ، بما في ذلك شوندرويتينسلفات ، كبريتات الكيراتان ، كبريتات ديرماتان ، الهيبارين ، الهيبارينوليبات ، وحمض الهيالورونيك. يحدث البروتوغليكانسديوكرين والفيبرومودولين والبيغليكان في جميع أنحاء SDFT والتأثير على وظائف المكونة للخلايا ، وتولد ليفي الكولاجين ، والترتيب الأبعاد للألياف. هذا يؤثر على قوة الوتر. من المحتمل أن يكون للبروتيوغليكان دور في تحجيم عوامل النمو داخل مصفوفة الكولاجين.
تتكون الأوتار في الغالب من الماء (حوالي 70 ٪) ؛ 30 ٪ المتبقية تحتوي على الكولاجين ومصفوفة خالية من الكولاجين.
إصابات الأوتار الشائعة للحصان
توصف إصابات الأوتار التي تحدث بشكل طبيعي بأنها "تمدد ليفي ، انزلاق ، وتمزيق ، تليها تحلل ليفي" مرتبط بـ "إطلاق الإنزيمات من الخلايا الليفية التالفة والخلايا الالتهابية" (Dowling ، 2000). تبدأ عملية الشفاء ، تليها مراحل الالتهاب والتكاثر وإعادة التشكيل والنضج. النوع الثالث من الكولاجين هو الأول من نوعه الذي يتم دمجه في موقع الإصابة ، ويشكل الوصلات المتقاطعة البينية التي توفر قوة وثبات مبكرين في موقع الإصابة. زيادة كميات من الأنواع الرابع والنوع الخامس الكولاجين ثم تطوير قريبا. بعد هذه المراحل الحادة ، تصبح ألياف الكولاجين من النوع الأول أكثر وضوحًا ، وتظهر ألياف ليفية الكولاجين من النوع الأول والنوع الثالث بكميات أقل إلى حد ما حتى حوالي 6 أشهر بعد الإصابة. بعد ذلك ، تسود ألياف ليفية الكولاجين من النوع الأول مرة أخرى ، مما يدل على استمرار إعادة عرض وتطبيع أنسجة الشفاء. قد توجد مستويات عالية غير طبيعية من الكولاجين من النوع الثالث وغياب أي مجموعة مستقيمة في فترة تصل إلى أربعة عشر شهراً بعد الإصابة. في الأنسجة الندبية الليفية ، يُعتقد أن الترتيب غير الطبيعي للمصفوفة وتكوينها ، والذي يحتوي على ميكانيكا حيوية أضعف بالمقارنة مع أنسجة الأوتار المتوسطة ، وانخفاض معدل الشفاء هو سبب ارتفاع معدل إعادة إصابة SDFT. لمزيد من المعلومات حول أوتار الخيول وإصابات الأوتار الشائعة (باستثناء إصابات الخنق) ، أوصي بالإشارة إلى دليل هويل للخيول من إصابات الأوتار والأربطة.
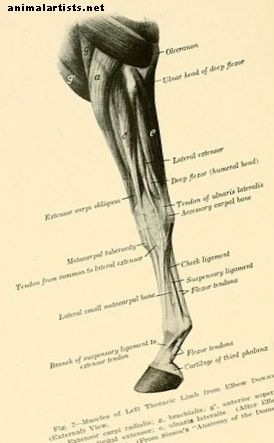
توصف إصابات الأوتار التي تحدث بشكل طبيعي بأنها "تمدد ليفي ، انزلاق ، وتمزيق ، تليها تحلل ليفي" مرتبط بـ "إطلاق الإنزيمات من الخلايا الليفية التالفة والخلايا الالتهابية".
خيارات العلاج الحالية في طب الخيول
هناك عدة خيارات مقبولة حاليًا لعلاج إصابات SDFT. يمكن تصنيف خيارات العلاج هذه في العلاجات الفيزيائية والدوائية والجراحية. توجد علاجات طبيعية في أشكال الجليد ، والعلاج المائي البارد ، وضمادات الضغط ، ومسند المماطلة ، وقد تم اعتبارها حجر الزاوية في المراحل الأولية من علاج إصابة SDFT من أجل الحد من الالتهاب وتقليل فرص حدوث مزيد من الضرر. وغالبا ما تستخدم العلاجات الفيزيائية جنبا إلى جنب مع العلاجات الدوائية. تشتمل أنظمة العلاج الدوائي عادةً على مضادات الالتهاب ، وهيالورونات الصوديوم ، والجليكوزامينوغليكان متعدد polysulphated ، وبيتا أمينوفبرونيتريل فومارات. تشمل الخيارات الجراحية التصحيحية حاليًا عملية إزالة عظمة الرباط التبعي ، وتقسيم الأوتار عن طريق الجلد ، وزرع الأوتار الاصطناعية ، والتآكل. تشمل خيارات العلاج الأخرى الأقل دراسة الموجات فوق الصوتية منخفضة الكثافة العلاجية والعلاج بالليزر منخفض الأشعة تحت الحمراء والعلاج بالمجال الكهرومغناطيسي. تباينت نتائج هذه العلاجات ، حيث كان هناك حد أدنى من البيانات الواضحة التي تفيد بأن أيًا من خيارات العلاج المذكورة أعلاه كانت لها فوائد موثوقة أو طويلة الأجل بشكل ثابت. ويرجع ذلك جزئيًا إلى التباين الواسع في تقنيات العلاج والأفضليات بين الأطباء البيطريين والمالكين.
توجد علاجات طبيعية في أشكال الجليد ، والعلاج المائي البارد ، وضمادات الضغط ، ومسند المماطلة ، وقد تم اعتبارها حجر الزاوية في المراحل الأولية من علاج إصابة SDFT من أجل الحد من الالتهاب وتقليل فرص حدوث مزيد من الضرر.
الخلايا الجذعية الوسيطة (MSC) العلاج في طب الخيول
الخلايا الجذعية الوسيطة هي خلايا جذعية متعددة العناصر غير ذات أهمية للدم لاستخدامها في علاج إصابات العظام في الخيول. يتم تصنيف الخلايا الجذعية إما على أنها خلايا جنينية أو خلايا بالغة ، وهذا يتوقف على مستوى تطور متبرعها. لغرض هذه الدراسة ، سيكون التركيز هنا على الخلايا البالغة. الخلايا الجذعية البالغة هي عبارة عن مجموعة من الخلايا الموجودة عادة في كل نوع من الأنسجة ، وتساعد على توفير شكل عضو مناسب خلال عمليات دوران الخلايا الخلوية المنتظمة. تتمتع هذه الخلايا الجذعية أيضًا بالقدرة على التمايز إلى أنواع خلايا أخرى من أصول الأنسجة المختلفة حسب الحاجة ، وهو ما يطلق عليه اللدونة الخلوية. تم تشجيع استخدام MSCs لتجديد الأنسجة لأول مرة على أساس هذه الفكرة من اللدونة الخلية. سيتم تحفيز الأنسجة التالفة بشكل مباشر عن طريق حقن الخلايا الجذعية السرطانية ، وتمتلئ الخلايا بموقع الإصابة ، وتتمايز في نوع الخلية المناسب لتلك الأنسجة ، وسيبدأ التجديد. وقد وجد في وقت لاحق أن هذه الخلايا من شأنها أن تحفز أيضا التجديد بشكل غير مباشر عن طريق إنتاج العوامل الغذائية الحيوية والمناعية.
الأنسجة الدهنية ونخاع العظم هما المصدران الأكثر شيوعًا لمصطلح MSCs المستخدم في طب الخيول ، على الرغم من أن مصادر مثل الدم المحيطي ودم الحبل السري تكتسب شعبية ، لأنها أقل انتشارًا. بالمقارنة مع MSCs الإنسان ، لا توجد حاليا معايير توصيف متاحة ل MSCs من أصول حيوانية. لذلك ، تستخدم العديد من الشركات طرقًا مختلفة لوصف MSCs الحيوانية ، مما يجعل من الصعب مقارنة نتائج البحوث والنتائج السريرية للعلاجات MSC المستخدمة في الخيول. بينما يمكن تصنيف MSCs من الحيوانات من خلال قدرتها على الالتزام بالبلاستيك والتفريق ، لا يزال من غير السهل التعرف على تعبير المستضد السطحي. هذا التوافر المحدود للأجسام المضادة المحددة في الطب البيطري يحد من إمكانات التنميط المناعي الحقيقي ل MSCs.
نتائج من دراسات MSC الحالية
في عام 2003 ، تم تحديد استخدام MSCs للاستخدام كعلاج لإصابات وتر الخيول لأول مرة ، مع نشر خمس مقالات بحثية فقط حول هذا الموضوع (Van de Walle، 2016). بعد هذا الحدث ، ارتفع استخدام MSCs في الطب التجديدي للخيول ، حيث يتم الآن علاج آلاف الخيول بهذه الطريقة. ومع ذلك ، لا تزال فعالية علاجات MSC في الخيول غير مؤكدة إلى حد ما ، حيث لا تستخدم مجموعات التحكم المناسبة دائمًا ، وغالبًا ما تستخدم العوامل البيولوجية الأخرى مع الخلايا الجذعية. ومع ذلك ، فقد أظهرت الأبحاث السابقة وجود علاقة إيجابية بين العلاج بالخلايا الجذعية الوسيطة وتجديد الأوتار السليمة في إصابات SDFT ، مع إظهار بعض انخفاض معدلات إعادة الإصابة (Badial ، 2013 ؛ كارفالهو ، 2011 ؛ غودوين ، 2013 ؛ غويرسيو ، 2015 ؛ سميث ، 2003).
استخدمت دراسة عام 2013 على وجه الخصوص أساليب مماثلة كما تفعل هذه الدراسة. في هذه الدراسة السابقة ، تم إحداث الآفات باستخدام حقن جل كولاجيناز في منطقة مشط القدم من SDFTs من ثمانية خيول من السلالات المختلطة. تم علاج الخيول في مجموعة العلاج عن طريق الحقن بين الخلايا الجذعية الوسيطة المستمدة من الأنسجة الدهنية المعلقة في تركيز الصفائح الدموية. بعد 16 أسبوعًا من العلاج ، تم إجراء الخزعات لتحليل التعبير النسجي ، المناعي ، والجيني. أوضحت نتائج هذه الدراسة أن استخدام الخلايا الجذعية الوسيطة وتركيز الصفائح الدموية حال دون تطور آفات الأوتار ، مما أدى إلى ترتيب الخلايا المتفوق ، وتقليل الالتهاب عند مقارنته بمجموعة التحكم. (باديال ، 2013)
لاحظت دراسة أجريت عام 2014 على تسع خيول مع إصابات SDFT الموجودة سابقًا ، وجود أدلة على أن عمليات النسيج التعويضي بعد المعالجة بعد استخدام الخلايا الجذعية الوسيطة المشتقة من الشحوم كطريقة علاجية (Guercio ، 2014). استخدمت دراسة مدتها سنتان عام 2012 لـ 141 من سباق الخيول المملوك للعميل مع إصابات موجودة سابقًا خلايا جذعية مشتقة من نخاع العظم بدلاً من الخلايا المشتقة من الشحوم ، لكن لم تلاحظ أي آثار ضارة للعلاج ؛ ومع ذلك ، لوحظ انخفاض كبير في معدلات إعادة الإصابة بين السباق (غودوين ، 2012).
على الرغم من أن هذه الدراسات السابقة حاولت جميعًا ملاحظة وجود علاقة بين إصابات SDFT والخلايا الجذعية الوسيطة ، إلا أن هناك العديد من العوامل المربكة والعديد من الثغرات الواضحة في هذا البحث. فشلت بعض الدراسات في استخدام كمية كافية من الموضوعات لتقديم أدلة قاطعة ، بينما استخدمت دراسات أخرى مجموعة واسعة من السلالات والأعمار والأجناس والتخصصات الرياضية. يستخدم آخرون أعدادًا مختلفة من الخلايا الجذعية وفترات العلاج. ولعل أكبر عامل مربك هو أن معظم هذه الدراسات استخدمت الخيول مع الإصابات الموجودة مسبقًا ، مما أدى إلى اختلاف كبير في حجم الإصابة وشدتها ومدتها وما إلى ذلك ، وفشل في تحديد ما إذا كانت هذه العوامل لها علاقة بالنتائج. باستخدام مجموعة أكبر من العمر والجنس والسلالات والحصون المقيدة بالانضباط ، يوجد عدد محدد مسبقًا من الخلايا الجذعية وإصابة محددة وخطة علاج وفاصل علاجية ، والسعي لإقامة علاقات بين هذه العوامل والنتائج ، ينبغي أن تسعى الدراسات الجديدة إلى الحد من العوامل المربكة والحصول على أدلة أكثر شمولية. اعتبارا من هذا الوقت ، هناك حاجة إلى إجراء بحوث إضافية للتحقيق في آثار العلاج بالخلايا الجذعية في الخيول.
إصابات SDFT و MSCs مسابقة
عرض إحصائيات المسابقةالمراجع
Badial، P.، Deffune، E.، Borges، A.، Carvalho، A.، Yamada، A.، arelvarez، L.، Garcia Alves، A. (2013). علاج التهاب الأوتار الخيلي باستخدام الخلايا الجذعية الوسيطة والصفائح الدموية: تجربة عشوائية محكومة. بحوث الخلايا الجذعية والعلاج ، 4 (4) ، 1-13. دوى: 10.1186 / scrt236
Crovace، A.، Lacitignola، L.، Rossi، G.، Francioso، E. (2009). التقييم النسيجي والمناعي للخلايا الجذعية الوسيطة لنخاع العظم المثقف ذاتي المنشأ والخلايا أحادية النواة لنخاع العظم في التهاب الأوتار الناجم عن الكولاجيناز في وتر الخيول الرقمية للثني السطحي. الطب البيطري الدولي ، 2010 ، 1-10. دوى: 10.4061 / 2010/25097
Dowling، BA، Dart، AJ، Hodgson، DR and Smith، RKW (2000)، التهاب الأوتار العضلي الثني السطحي الرقمي في الحصان. مجلة الخيول البيطرية ، 32: 369-378. دوى: 10.2746 / 042516400777591138
Godwin، EE، Young، NJ، Dudhia، J.، Beamish، IC and Smith، RKW (2012). يوضح زرع الخلايا الجذعية الوسيطة المشتقة من النخاع العظمي نتائج محسّنة في الخيول مع إصابة مفرطة في وتر المثنية الرقمية السطحية. مجلة الخيول البيطرية ، 44 (1): 25-32. دوى: 10.1111 / j.2042-3306.2011.00363.x
Guercio، A.، Di Marco، P.، Casella، S.، Russotto، L.، Puglisi، F.، Majolino، C.، Piccione، G. (2015). الخلايا الجذعية الوسيطة المستمدة من الدهون تحت الجلد والبلازما الغنية بالصفائح الدموية المستخدمة في الخيول الرياضية مع عرج في وتر المثنية الرقمية السطحية. مجلة العلوم البيطرية الخيول ، 35 (1) ، 19-26. دوى: 10.1016 / j.jevs.2014.10.006
Richardson LE، Dudhia J.، Clegg PD، Smith، R. (2007). الخلايا الجذعية في الطب البيطري - محاولات لتجديد وتر الخيول بعد الإصابة. الاتجاهات في التكنولوجيا الحيوية ، 25 (9) ، 409-16.
Van de Walle، G.، De Schauwer، C.، Fortier، L. (2016). علاج الخلايا الجذعية الوسيطة. علم المناعة السريري للخيول (الطبعة الأولى) جون وايلي وأولاده ، تم استرجاعه من https://lmunet.illiad.oclc.org/illiad/TNF/illiad.dll؟Action=10&Form=75&Value=25484